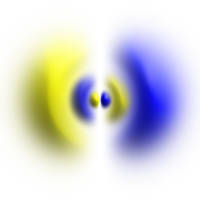
Atomorbital

Obere Reihe: Darstellung der Wahrscheinlichkeitsdichten der Orbitale als Punktwolken.
Untere Reihe: Darstellung von Isoflächen von . Die Isofläche ist jeweils so gewählt, dass sich das Elektron innerhalb des von der Isofläche umschlossenen Volumens mit 90 % Wahrscheinlichkeit aufhält.
Ein Atomorbital ist in den quantenmechanischen Modellen der Atome die räumliche Wellenfunktion eines einzelnen Elektrons in einem quantenmechanischen Zustand, meist in einem stationären Zustand. Sein Formelzeichen ist meist (kleines Phi) oder (kleines Psi). Das Betragsquadrat beschreibt als Dichtefunktion die räumliche Verteilung der Aufenthaltswahrscheinlichkeit, mit der das Elektron am Ort gefunden werden kann (bornsche Wahrscheinlichkeitsinterpretation der Quantenmechanik). Zusammen mit der Angabe, ob der Spin zu einer festen Achse oder zum Bahndrehimpuls des Elektrons parallel oder antiparallel ausgerichtet ist, beschreibt ein Orbital den Elektronenzustand vollständig.
In den älteren Atommodellen nach Niels Bohr (Bohrsches Atommodell, 1913) und Arnold Sommerfeld (Bohr-Sommerfeldsches Atommodell, 1916) beschreibt ein Orbital eine genaue, durch die Quantisierungsregeln ausgewählte Elektronenbahn. Diese Vorstellung wurde in der Quantenmechanik zugunsten einer diffusen Verteilung der Aufenthaltswahrscheinlichkeit des Elektrons aufgegeben. Das quantenmechanische Atomorbital erstreckt sich für gebundene Elektronen vom Atomkern im Zentrum nach außen bis ins Unendliche, wo die Aufenthaltswahrscheinlichkeit asymptotisch gegen null geht. Der wahrscheinlichste Abstand vom Atomkern ist für das innerste Orbital gleich dem Radius der 1. bohrschen Kreisbahn.
Anschaulich stellt man ein Orbital gewöhnlich durch die Oberfläche des kleinstmöglichen Volumens dar, in dessen Inneren sich das Elektron mit großer (z. B. 90%iger) Wahrscheinlichkeit aufhält (s. Abbildung). Man erhält damit Körper, die ungefähr der Größe und Form der Atome entsprechen, wie sie sich in chemischen Molekülen, kondensierter Materie und der kinetischen Gastheorie bemerkbar machen.
Die gebräuchlichsten Atomorbitale sind die, die sich für das einzige Elektron des Wasserstoffatoms als Lösungen der Schrödingergleichung des Wasserstoffproblems ergeben und 1926 erstmals veröffentlicht wurden. Sie haben verschiedene Formen, die mit bezeichnet werden, wobei der untere Index aus der Hauptquantenzahl der Bahndrehimpulsquantenzahl und der magnetischen Quantenzahl besteht.
Im Orbitalmodell für Atome mit mehreren Elektronen nimmt man an, dass die Elektronen sich unter Berücksichtigung des Pauli-Prinzips auf die Orbitale verteilen. Ein solcher Zustand heißt Elektronenkonfiguration und stellt oft eine brauchbare Näherung für die Struktur der Atomhülle dar, obwohl diese durch zusätzliche Elektronenkorrelationen noch komplizierter ist.
Zur Beschreibung von Elektronen in Molekülen werden Molekülorbitale als Linearkombination von Atomorbitalen gebildet. Elektronen in Festkörpern werden durch Orbitale beschrieben, die die Form von Blochwellenfunktionen haben.
In diesem Artikel wird nur auf gebundene Elektronen in Atomen eingegangen. Eine Vereinfachung des Orbitalmodells ist das Schalenmodell.
Darstellung
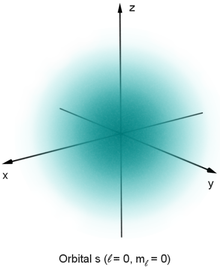
Da die vollständige graphische Darstellung einer Wellenfunktion vier Dimensionen benötigte (bzw. fünf Dimensionen, falls ), ist eine vollständige Darstellung im Dreidimensionalen nicht direkt möglich (aber zum Beispiel unter Zuhilfenahme einer Farbcodierung wie unten in der Tabelle). Wie vom Wasserstoffatom bekannt ist, haben die Eigenfunktionen der stationären Schrödingergleichung einen Radialanteil und einen Winkelanteil :
Diese Anteile können getrennt gezeichnet werden. Häufig zeigen Bilder von Orbitalen jedoch eine Darstellung der Wahrscheinlichkeitsdichte (und damit indirekt der Orbitale ). Besonders einleuchtend könnte die Wahrscheinlichkeitsdichte als Punktwolke visualisiert werden: Ist die Wahrscheinlichkeitsdichte groß, so werden viele Punkte gezeichnet; ist die Wahrscheinlichkeitsdichte klein, werden wenige Punkte gezeichnet. Da die Wahrscheinlichkeitsdichte jedoch an fast allen Punkten (ausgenommen der Knotenpunkte der Wellenfunktion) im Raum ungleich null ist, kann ein Orbital auf diese Weise dennoch nicht völlig dargestellt werden – da man ja bis ins Unendliche weiterhin Punkte zeichnen müsste. Stattdessen geht man dazu über, Isoflächen gleicher Wahrscheinlichkeitsdichte zu zeichnen, die implizit durch
definiert sind. Durch Abtasten verschiedener Winkel erfährt man etwas über die Form der Isofläche und somit etwas über die „Form des Orbitals“. Die Form des Orbitals wird durch eine Kugelflächenfunktion vorgegeben. Häufig wird die Konstante so gewählt, dass die Wahrscheinlichkeit, das Elektron in dem von der Isofläche umschlossenen Raum zu finden, 90 % beträgt.
Nicht selten wird bei der Darstellung einer Isofläche von die Fläche entsprechend dem Argument von koloriert (wie in dem Bild des p-Orbitals).
Eine einfache Art der schematischen Darstellung der Besetzung von Atomorbitalen ist die Pauling-Schreibweise.
Klassifikation
Atomorbitale können durch drei Quantenzahlen festgelegt werden und bieten dann Platz für zwei Elektronen mit entgegengesetztem Spin. Alternativ können Atomorbitale durch vier Quantenzahlen festgelegt werden und bieten dann Platz für nur jeweils ein Elektron.
Hauptquantenzahl n: Schale
Die Hauptquantenzahl bezeichnet die Schale (Bezeichnung auch K-Schale, L-Schale, M-Schale, …), zu der das Orbital gehört. Im bohrschen Atommodell gibt das Energieniveau an, beginnend mit dem tiefsten, dem Grundzustand
Je größer , desto geringer die Bindungsenergie des Elektrons und damit desto größer die Wahrscheinlichkeit, das Elektron weiter entfernt vom Atomkern zu finden. Das gilt auch für Atome mit mehreren Elektronen. Bei Wechselwirkungen zwischen Atomen, die sich nahe kommen, (wie Stößen von Gasmolekülen, Raumerfüllung in kondensierter Materie, chemischen Bindungen) spielen deshalb die Elektronen mit der größten Hauptquantenzahl die wichtigste Rolle (die Elektronen der Valenzschale).
Die Anzahl der -Orbitale in einer Schale ergibt sich zu Unter Berücksichtigung des Pauli-Prinzips kann die Schale mit maximal Elektronen besetzt werden, dann ist sie abgeschlossen. Die entsprechenden Atome gehören zu den Edelgasen.
Neben- oder Bahndrehimpuls-Quantenzahl l
Form
Die Neben- oder Bahndrehimpulsquantenzahl innerhalb einer Schale beschreibt den Betrag des Bahndrehimpulses des Elektrons. Mit der Quantenzahl zusammen wird damit die winkelabhängige „Form“ des Orbitals festgelegt. Sie ist für alle Hauptquantenzahlen (beachte ) dieselbe.
Statt der Ziffern 0, 1, 2 etc. wird die Nebenquantenzahl in der Literatur meist durch die Buchstaben s, p, d, f, g etc. bezeichnet, abgeleitet aus den ursprünglichen Bezeichnungen für die korrespondierenden Spektrallinien; diese konkrete Bedeutung ist seit langem unwesentlich geworden:
| Name | ehemalige Bedeutung | Nebenquantenzahl | Form | Anzahl |
|---|---|---|---|---|
| s-Orbital | sharp | kugelsymmetrisch | 1 | |
| p-Orbital | principal | hantelförmig | 3A2 | |
| d-Orbital | diffuse | gekreuzte Doppelhantel | 5 | |
| f-Orbital | fundamental | rosettenförmig | 7 | |
| g-OrbitalA1 | (alphabetische Fortsetzung) | rosettenförmig | 9 | |
| h-OrbitalA1 | (alphabetische Fortsetzung) | rosettenförmig | 11 |
Anmerkungen:
Die Orbitale charakterisieren streng genommen nur die stationären Elektronen-Wellen in Systemen mit nur einem Elektron (wie z. B. Wasserstoffatom H, Heliumion He+, Lithiumion Li2+ usw.). Da die Form der Orbitale auch in Mehrelektronensystemen in etwa erhalten bleibt, reicht ihre Kenntnis aus, um viele qualitative Fragen zur chemischen Bindung und zum Aufbau von Stoffen zu beantworten.
Dabei ist zu beachten, dass die in der Literatur dargestellten Orbitale zuweilen nicht die Eigenzustände zur magnetischen Quantenzahl der z-Komponente des Drehimpulsoperators sind. Z. B. wird von den p-Orbitalen nur der eine Eigenzustand für den Eigenwert dargestellt und als pz bezeichnet. Die mit px und py bezeichneten Orbitale sind jedoch nicht die entsprechenden Eigenzustände für sondern sind deren Superpositionen. Sie sind Eigenzustände zu den Operatoren bzw. jeweils zu die aber nicht mit kommutieren. Für die Schlussfolgerungen ist das kein Problem, solange die entsprechenden Wellenfunktionen orthogonal sind.
Unterschale
Je größer , desto größer ist bei festem die mittlere Entfernung des Elektrons vom Atomkern:
- Bei ist das Orbital kugelförmig und hat auch bei also im Kern, eine nichtverschwindende Aufenthaltswahrscheinlichkeit.
- Der Maximalwert entspricht der bohrschen Kreisbahn, hier konzentriert sich die Aufenthaltswahrscheinlichkeit bei dem im bohrschen Modell berechneten Radius.
Da bei Atomen mit mehreren Elektronen die inneren Elektronen die anziehende Kernladung abschirmen, verringert sich die Bindungsenergie der äußeren Elektronen. Da die mittleren Kernabstände von der Nebenquantenzahl abhängen, ergeben sich zum gleichen je nach Nebenquantenzahl verschiedene Energieniveaus innerhalb derselben Schale. Diese werden auch als Unterschalen der Hauptschale (zu festem ) bezeichnet.
Die Anzahl der Unterschalen je Schale ist gleich der Hauptquantenzahl :
- Für gibt es nur die 1s-Schale.
- Für sind drei Unterschalen möglich, die mit 3s, 3p, 3d bezeichnet werden.
Pro Unterschale gibt es Orbitale (jeweils mit anderer Magnetquantenzahl , s. folgenden Abschnitt), was auf insgesamt Orbitale pro Schale führt.
Magnetquantenzahl ml: Neigung des Drehimpulsvektors
Die Magnetquantenzahl
gibt die z-Komponente des Bahndrehimpulsvektors gegenüber einer (frei gewählten) z-Achse an. Das entspricht anschaulich einem Neigungswinkel
- Bei liegt der Bahndrehimpuls (etwa) parallel zur Achse,
- bei (etwa) antiparallel.
Dass bei gegebenem genau verschiedene Werte möglich sind, wird als Richtungsquantelung bezeichnet.
Wenn kein äußeres Feld anliegt, haben die einzelnen Orbitale einer Unterschale gleiche Energie. Dagegen spaltet im Magnetfeld die Energie innerhalb der Unterschale in äquidistante Werte auf (Zeeman-Effekt), d. h., jedes einzelne Orbital entspricht dann einem separaten Energieniveau.
Magnetische Spinquantenzahl ms
Bei den leichteren Atomen braucht man den Elektronenspin nur in der Form zu berücksichtigen, dass jedes Orbital von genau einem Elektronenpaar besetzt werden kann, dessen zwei Elektronen nach dem Pauli-Prinzip entgegengesetzte magnetische Spinquantenzahlen aufweisen ().
Gesamtdrehimpuls j und magnetische Quantenzahl mj
Zu den schweren Atomen hin wird die Spin-Bahn-Wechselwirkung stärker. Sie bewirkt die Aufspaltung der Energie einer Unterschale mit bestimmten in zwei Unterschalen, je nach Wert des Gesamtdrehimpulses Die magnetische Quantenzahl durchläuft Werte. Jedes dieser Orbitale kann von einem Elektron besetzt werden, sodass die Gesamtzahl der Plätze gleich bleibt. In der Bezeichnung wird der Wert für als unterer Index an das Symbol für angefügt, z. B.
Quantentheorie
Aus der nichtrelativistischen Quantentheorie ergeben sich die Orbitale wie folgt: Die Wechselwirkung zwischen Elektron und Atomkern wird durch das Coulombpotential beschrieben, der Atomkern als fix angenommen. Der Hamiltonoperator für das Ein-Elektron-System ist
mit dem Potential
- .
Da der Hamiltonoperator mit dem Drehimpulsoperator kommutiert, bilden und ein vollständiges System kommutierender Observablen. Zu diesen drei Operatoren gibt es also gemeinsame Eigenzustände, die durch die drei zugehörigen Quantenzahlen bestimmt sind.
Die Schrödingergleichung
lässt sich in einen radius- und einen winkelabhängigen Teil zerlegen. Die Eigenfunktionen sind das Produkt aus einer Kugelflächenfunktion (Eigenfunktion des Drehimpulsoperators) und einer radialen Funktion
Diese sind bis in der folgenden Tabelle normiert dargestellt. Dabei bezeichnen den Bohrschen Radius und die Kernladungszahl.
Die in der folgenden Tabelle dargestellten Orbitale sind alle um die z-Achse ausgerichtet, weil es sich um Eigenfunktionen des -Operators handelt. Für Ausrichtung eines Orbitals mit gegebenem Bahndrehimpuls in eine beliebige andere Richtung muss man Linearkombinationen der Wellenfunktionen zu den verschiedenen bilden. Die grafische Darstellung zeigt ein Volumen, auf dessen Oberfläche die Aufenthaltswahrscheinlichkeitsdichte konstant ist. Die Farben kodieren die komplexe Phase der Wellenfunktion.
| Orbital | Wellenfunktion des Orbitals | Form des Orbitals (nicht maßstäblich) | |||
|---|---|---|---|---|---|
| 1s | 1 | 0 | 0 |
|
|
| 2s | 2 | 0 | 0 |

|
|
| 2p0 | 2 | 1 | 0 |

|
|
| 2p-1/+1 | 2 | 1 | ±1 |


|
|
| 3s | 3 | 0 | 0 |

|
|
| 3p0 | 3 | 1 | 0 |

|
|
| 3p-1/+1 | 3 | 1 | ±1 |
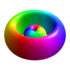
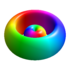
|
|
| 3d0 | 3 | 2 | 0 |

|
|
| 3d-1/+1 | 3 | 2 | ±1 |


|
|
| 3d-2/+2 | 3 | 2 | ±2 |


|
|
Natürliches Orbital
Ein natürliches Orbital ist ein Orbital, das sich nicht als Eigenfunktion eines Hamiltonoperators ergibt, sondern als Eigenfunktion eines Einelektronen-Dichteoperators. Dieser wird aus einer vorgegebenen Vielteilchenwellenfunktion gewonnen, die beispielsweise auch Elektronenkorrelationen enthalten kann und damit über den Rahmen eines Einzelteilchenmodells hinausgeht. Die natürlichen Orbitale ergeben die beste Annäherung an den gegebenen Vielteilchenzustand, die mit einem Einzelteilchenmodell möglich ist.
Zeitabhängigkeit
Werden Orbitale als Eigenfunktionen eines Operators definiert, der zu einer Energie korrespondiert, dann sind diese Orbitale im Rahmen des gewählten Modells stationär. Beispiele hierfür sind die Hartree-Fock-Orbitale als Eigenfunktionen des Fockoperators und die Kohn-Sham-Orbitale, die Eigenfunktionen des Kohn-Sham-Hamilton-Operators sind. Im Gegensatz dazu sind die sogenannten natürlichen Orbitale, als Eigenfunktionen des reduzierten Einelektronen-Dichteoperators, nicht stationär.
Hybridisierung
Einige Symmetrien von chemischen Bindungen scheinen den charakteristischen Formen der Orbitale zu widersprechen. Diese Bindungen werden durch die Bildung von Hybrid-Orbitalen verständlich, die sich bei Anwesenheit von Elektronen mit verschiedenem Bahndrehimpuls bilden können, wenn sie energetisch nahezu gleichwertig sind (siehe oben).
Mehr-Elektronen-Wellenfunktionen
Die Interpretation von Orbitalen als Wellenfunktionen je eines Elektrons ist nur bei Einzelelektronensystemen eindeutig möglich. Eine Wellenfunktion für N Elektronen kann dann konstruiert werden, indem man N Orbitale in eine Slater-Determinante einsetzt. Dies garantiert die für Fermionen notwendige Antisymmetrie der gesamten Wellenfunktion, kann aber darüber hinaus gehende Elektronenkorrelationen nicht darstellen. Um auch die Elektron-Elektron-Wechselwirkung näherungsweise zu berücksichtigen, können die Orbitale durch Hartree-Fock-, Kohn-Sham-Rechnungen (siehe: Dichtefunktionaltheorie in der Quantenphysik) oder MCSCF-Rechnungen (MCSCF: Multiconfiguration Self Consistent Field) bestimmt werden. Doch stets bleibt gültig, dass anders gewählte Orbitale, wenn sie linear unabhängige Linearkombinationen der ursprünglichen sind, mathematisch die gleiche Slater-Determinante ergeben, sodass man aus einer gegebenen Mehrteilchen-Wellenfunktion nicht eindeutig zurückschließen kann, welches die einzelnen besetzten Orbitale sind.
Literatur
- Wolfgang Demtröder: Atome, Moleküle und Festkörper. 3. Auflage. Springer, 2002, ISBN 3-540-21473-9.
Weblinks
- Wasserstoff-Orbitale bei mikomma.de
- 3D-Darstellungen von Orbitalen der University of Sheffield
- 3D-Darstellung verschiedener Orbitale und ein Programm zur Berechnung der Bilder
License Information of Images on page#
| Image Description | Credit | Artist | License Name | File |
|---|---|---|---|---|
| Datei:AOs-3D-dots.png | ||||
| Atomic hydrogen -like single-electron orbital showing ( ψ n = 4 , l = 1 , m = − 1 − ψ n = 4 , l = 1 , m = 1 ) / 2 \displaystyle (\psi _n=4,l=1,m=-1-\psi _n=4,l=1,m=1)/\sqrt 2 , also called 4px-orbital for its alignment in x-direction. The image is a 3D rendering of the spatial density distribution of 𝜓² with the color depicting the phase of 𝜓. The spatial distribution is smooth and vanishes for large radii. The cloud is a more realistic representation of an orbital than the more common solid-body approximations. At full resolution, 1 Å =6.3px. | Diese PNG- Rastergrafik wurde mit Python erstellt. | Geek3 | Datei:Atomic-orbital-cloud n4 px.png | |
| The Wikimedia Commons logo, SVG version. | Original created by Reidab ( PNG version ) SVG version was created by Grunt and cleaned up by 3247 . Re-creation with SVG geometry features by Pumbaa , using a proper partial circle and SVG geometry features. (Former versions used to be slightly warped.) | Reidab , Grunt , 3247 , Pumbaa | Datei:Commons-logo.svg | |
| Computed 1s 0 orbital of an electron's eigenstate of the energy- and angular momentum operators in the Coulomb-field of a hydrogen nucleus. Such an eigenstate keeps its spatial shape over time while obeying the Schrödinger equation and only advances its complex phase. The wavefunction is: ψ 1 , 0 , 0 ( r , ϑ , φ ) = ( 2 a 0 ) 3 1 2 ⋅ e − r / a 0 ⋅ 1 4 π \displaystyle \psi _1,0,0(r,\vartheta ,\varphi )=\sqrt \left(\frac 2a_0\right)^3\frac 12\cdot e^\textstyle -r/a_0\cdot \frac 1\sqrt 4\,\pi The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 1: Energy : E = − 1 R y / n 2 = − 13.6 e V \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV l = 0: Angular momentum : L = l ( l + 1 ) ℏ = 0 \displaystyle L=\sqrt l\,(l+1)\,\hbar =0 m = 0: Angular momentum in z-direction : L z = m ℏ = 0 \displaystyle L_z=m\,\hbar =0 Since l=0, this is called a s-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . A wedge was cut away from the orbital to make the internal structure visible. | Eigenes Werk , Created with hydrogen 1.1 | Geek3 | Datei:Hydrogen eigenstate n1 l0 m0 wedgecut.png | |
| Computed 2s 0 orbital of an electron's eigenstate of the energy- and angular momentum operators in the Coulomb-field of a hydrogen nucleus. Such an eigenstate keeps its spatial shape over time while obeying the Schrödinger equation and only advances its complex phase. The wavefunction is: ψ 2 , 0 , 0 ( r , ϑ , φ ) = ( 1 a 0 ) 3 1 8 ⋅ e − r / ( 2 a 0 ) ⋅ L 1 1 ( r / a 0 ) ⋅ 1 4 π \displaystyle \psi _2,0,0(r,\vartheta ,\varphi )=\sqrt \left(\frac 1a_0\right)^3\frac 18\cdot e^\textstyle -r/(2\,a_0)\cdot L_1^1(r/a_0)\cdot \frac 1\sqrt 4\,\pi The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 2: Energy : E = − 1 R y / n 2 = − 13.6 e V / 4 \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV /4 l = 0: Angular momentum : L = l ( l + 1 ) ℏ = 0 \displaystyle L=\sqrt l\,(l+1)\,\hbar =0 m = 0: Angular momentum in z-direction : L z = m ℏ = 0 \displaystyle L_z=m\,\hbar =0 Since l=0, this is called a s-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . A wedge was cut away from the orbital to make the internal structure visible. | Eigenes Werk , Created with hydrogen 1.1 | Geek3 | Datei:Hydrogen eigenstate n2 l0 m0 wedgecut.png | |
| Calculated 2p -1 orbital of an electron's eigenstate in the Coulomb-field of a hydrogen nucleus. An eigenstate is a state which keeps it's shape except for a complex phase when the Hamilton operator is applied, thus being invariant in time while obeying the Schrödinger equation . The orbital is aligned around the z-axis, but remains an eigenfunction if rotated to any direction. The wavefunction is: ψ 2 , 1 , − 1 ( r , ϑ , φ ) = ( 1 a 0 ) 3 1 24 ⋅ e − r / ( 2 a 0 ) ⋅ ( r a 0 ) ⋅ Y 1 − 1 ( ϑ , φ ) \displaystyle \psi _2,1,-1(r,\vartheta ,\varphi )=\sqrt \left(\frac 1a_0\right)^3\frac 124\cdot e^\textstyle -r/(2\,a_0)\cdot \left(\frac ra_0\right)\cdot Y_1^-1(\vartheta ,\varphi ) The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 2: Energy : E = − 1 R y / n 2 = − 13.6 e V / 4 \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV /4 l = 1: Angular momentum : L = l ( l + 1 ) ℏ = 2 ℏ \displaystyle L=\sqrt l\,(l+1)\,\hbar =\sqrt 2\,\hbar m = -1: Angular momentum in z-direction : L z = m ℏ = − ℏ \displaystyle L_z=m\,\hbar =-\hbar Since l=1, this is called a p-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . The fine structure is neglected. | Eigenes Werk , Created with hydrogen 1.0 | Geek3 | Datei:Hydrogen eigenstate n2 l1 m-1.png | |
| Calculated 2p 0 orbital of an electron's eigenstate in the Coulomb-field of a hydrogen nucleus. An eigenstate is a state which keeps it's shape except for a complex phase when the Hamilton operator is applied, thus being invariant in time while obeying the Schrödinger equation . The orbital is aligned around the z-axis, but remains an eigenfunction if rotated to any direction. The wavefunction is: ψ 2 , 1 , 0 ( r , ϑ , φ ) = ( 1 a 0 ) 3 1 24 ⋅ e − r / ( 2 a 0 ) ⋅ ( r a 0 ) ⋅ Y 1 0 ( ϑ , φ ) \displaystyle \psi _2,1,0(r,\vartheta ,\varphi )=\sqrt \left(\frac 1a_0\right)^3\frac 124\cdot e^\textstyle -r/(2\,a_0)\cdot \left(\frac ra_0\right)\cdot Y_1^0(\vartheta ,\varphi ) The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 2: Energy : E = − 1 R y / n 2 = − 13.6 e V / 4 \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV /4 l = 1: Angular momentum : L = l ( l + 1 ) ℏ = 2 ℏ \displaystyle L=\sqrt l\,(l+1)\,\hbar =\sqrt 2\,\hbar m = 0: Angular momentum in z-direction : L z = m ℏ = 0 \displaystyle L_z=m\,\hbar =0 Since l=1, this is called a p-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . The fine structure is neglected. | Eigenes Werk , Created with hydrogen 1.0 | Geek3 | Datei:Hydrogen eigenstate n2 l1 m0.png | |
| Calculated 2p 1 orbital of an electron's eigenstate in the Coulomb-field of a hydrogen nucleus. An eigenstate is a state which keeps it's shape except for a complex phase when the Hamilton operator is applied, thus being invariant in time while obeying the Schrödinger equation . The orbital is aligned around the z-axis, but remains an eigenfunction if rotated to any direction. The wavefunction is: ψ 2 , 1 , 1 ( r , ϑ , φ ) = ( 1 a 0 ) 3 1 24 ⋅ e − r / ( 2 a 0 ) ⋅ ( r a 0 ) ⋅ Y 1 1 ( ϑ , φ ) \displaystyle \psi _2,1,1(r,\vartheta ,\varphi )=\sqrt \left(\frac 1a_0\right)^3\frac 124\cdot e^\textstyle -r/(2\,a_0)\cdot \left(\frac ra_0\right)\cdot Y_1^1(\vartheta ,\varphi ) The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 2: Energy : E = − 1 R y / n 2 = − 13.6 e V / 4 \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV /4 l = 1: Angular momentum : L = l ( l + 1 ) ℏ = 2 ℏ \displaystyle L=\sqrt l\,(l+1)\,\hbar =\sqrt 2\,\hbar m = 1: Angular momentum in z-direction : L z = m ℏ = ℏ \displaystyle L_z=m\,\hbar =\hbar Since l=1, this is called a p-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . The fine structure is neglected. | Eigenes Werk , Created with hydrogen 1.0 | Geek3 | Datei:Hydrogen eigenstate n2 l1 m1.png | |
| Computed 3s 0 orbital of an electron's eigenstate of the energy- and angular momentum operators in the Coulomb-field of a hydrogen nucleus. Such an eigenstate keeps its spatial shape over time while obeying the Schrödinger equation and only advances its complex phase. The wavefunction is: ψ 3 , 0 , 0 ( r , ϑ , φ ) = ( 2 3 a 0 ) 3 1 18 ⋅ e − r / ( 3 a 0 ) ⋅ L 2 1 ( 2 r / ( 3 a 0 ) ) ⋅ 1 4 π \displaystyle \psi _3,0,0(r,\vartheta ,\varphi )=\sqrt \left(\frac 23\,a_0\right)^3\frac 118\cdot e^\textstyle -r/(3\,a_0)\cdot L_2^1(2\,r/(3\,a_0))\cdot \frac 1\sqrt 4\,\pi The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 3: Energy : E = − 1 R y / n 2 = − 13.6 e V / 9 \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV /9 l = 0: Angular momentum : L = l ( l + 1 ) ℏ = 0 \displaystyle L=\sqrt l\,(l+1)\,\hbar =0 m = 0: Angular momentum in z-direction : L z = m ℏ = 0 \displaystyle L_z=m\,\hbar =0 Since l=0, this is called a s-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . A wedge was cut away from the orbital to make the internal structure visible. | Eigenes Werk , Created with hydrogen 1.1 | Geek3 | Datei:Hydrogen eigenstate n3 l0 m0 wedgecut.png | |
| Calculated 3p -1 orbital of an electron's eigenstate in the Coulomb-field of a hydrogen nucleus. An eigenstate is a state which keeps it's shape except for a complex phase when the Hamilton operator is applied, thus being invariant in time while obeying the Schrödinger equation . The orbital is aligned around the z-axis, but remains an eigenfunction if rotated to any direction. The wavefunction is: ψ 3 , 1 , − 1 ( r , ϑ , φ ) = ( 2 3 a 0 ) 3 1 6 ⋅ 4 ! ⋅ e − r / ( 3 a 0 ) ⋅ ( 2 r 3 a 0 ) ⋅ L 1 3 ( 2 r / ( 3 a 0 ) ) ⋅ Y 1 − 1 ( ϑ , φ ) \displaystyle \psi _3,1,-1(r,\vartheta ,\varphi )=\sqrt \left(\frac 23\,a_0\right)^3\frac 16\cdot 4!\cdot e^\textstyle -r/(3\,a_0)\cdot \left(\frac 2\,r3\,a_0\right)\cdot L_1^3(2\,r/(3\,a_0))\cdot Y_1^-1(\vartheta ,\varphi ) The state is an eigenstate of H, L² and L z , which constitute a complete set of commuting observables . The quantum numbers mean that the following quantities have a sharp certain value: n = 3: Energy : E = − 1 R y / n 2 = − 13.6 e V / 9 \displaystyle E=-1\,\mathrm Ry /n^2=-13.6\,\mathrm eV /9 l = 1: Angular momentum : L = l ( l + 1 ) ℏ = 2 ℏ \displaystyle L=\sqrt l\,(l+1)\,\hbar =\sqrt 2\,\hbar m = -1: Angular momentum in z-direction : L z = m ℏ = − ℏ \displaystyle L_z=m\,\hbar =-\hbar Since l=1, this is called a p-orbital. The depicted rigid body is where the probability density exceeds a certain value. The color shows the complex phase of the wavefunction, where blue means real positive, red means imaginary positive, yellow means real negative and green means imaginary negative. The image is raytraced using modified Phong lighting . The fine structure is neglected. | Eigenes Werk , Created with hydrogen 1.0 | Geek3 | Datei:Hydrogen eigenstate n3 l1 m-1.png |